醫(yī)療器械技術(shù)要求是確保產(chǎn)品安全、有效和質(zhì)量可控的重要文件,也是醫(yī)療器械注冊和監(jiān)管的核心依據(jù)。其編寫需遵循科學(xué)性、規(guī)范性、可操作性的原則,并嚴(yán)格依據(jù)相關(guān)法規(guī)和標(biāo)準(zhǔn)進(jìn)行。以下是醫(yī)療器械技術(shù)要求編寫的關(guān)鍵步驟與內(nèi)容指南。
一、法規(guī)與標(biāo)準(zhǔn)依據(jù)
醫(yī)療器械技術(shù)要求的編制應(yīng)首先明確適用的法規(guī)和技術(shù)標(biāo)準(zhǔn)。在中國,需參考《醫(yī)療器械監(jiān)督管理條例》、GB/T 16886系列標(biāo)準(zhǔn)(生物相容性)、YY/T 0287(質(zhì)量管理體系)等。同時,針對特定產(chǎn)品類別(如植入物、診斷設(shè)備等),還需遵循專項標(biāo)準(zhǔn),確保技術(shù)要求與現(xiàn)行法規(guī)及行業(yè)要求一致。
二、基本結(jié)構(gòu)
技術(shù)要求通常包括以下部分:
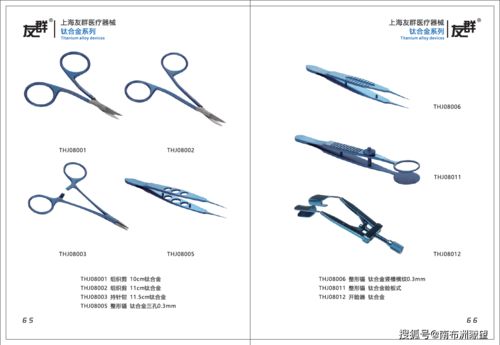
- 產(chǎn)品名稱、型號規(guī)格及其劃分說明:明確產(chǎn)品的標(biāo)識信息,包括所有型號、規(guī)格及其差異。
- 性能指標(biāo):詳細(xì)列出產(chǎn)品的物理、化學(xué)、生物性能要求,例如精度、強(qiáng)度、無菌性、電氣安全等。指標(biāo)應(yīng)可量化、可驗證。
- 檢驗方法:對應(yīng)性能指標(biāo),規(guī)定具體的測試方法、設(shè)備和條件,確保結(jié)果可重復(fù)。
- 附錄和引用文件:列出所有引用的標(biāo)準(zhǔn)、法規(guī)和技術(shù)文獻(xiàn),以增強(qiáng)文件的權(quán)威性和透明度。
三、編寫要點
- 明確性能要求:技術(shù)要求應(yīng)基于產(chǎn)品的預(yù)期用途和風(fēng)險分析,涵蓋安全性、有效性和可靠性。例如,對于有源設(shè)備,需包括電氣安全、電磁兼容性等;對于無菌產(chǎn)品,需規(guī)定無菌保證水平。
- 語言準(zhǔn)確簡潔:避免模糊表述,使用標(biāo)準(zhǔn)化術(shù)語,確保內(nèi)容易于理解和執(zhí)行。
- 與注冊資料一致:技術(shù)要求需與產(chǎn)品注冊申報資料(如研究數(shù)據(jù)、臨床評價)相協(xié)調(diào),防止矛盾。
- 更新與維護(hù):隨著法規(guī)或技術(shù)發(fā)展,技術(shù)要求應(yīng)及時修訂,并保留版本記錄。
四、常見問題與對策
編寫中常出現(xiàn)指標(biāo)不具體、檢驗方法不明確等問題。建議在起草階段多與測試機(jī)構(gòu)、監(jiān)管專家溝通,參考同類產(chǎn)品已獲批的技術(shù)要求模板,并進(jìn)行內(nèi)部評審,以提升文件質(zhì)量。
醫(yī)療器械技術(shù)要求的編寫是產(chǎn)品生命周期中的關(guān)鍵環(huán)節(jié)。通過系統(tǒng)化、規(guī)范化的方法,企業(yè)不僅能加快注冊進(jìn)程,更能保障產(chǎn)品上市后的安全與效能,為公眾健康提供堅實支持。